THE SILENT SPIRAL: GLOBAL POLITICS, ENVIRONMENTAL PATHWAYS, AND THE MULTISECTORAL DRIVERS OF ANTIMICROBIAL RESISTANCE
- S.S.TEJASKUMAR

- Nov 24, 2025
- 25 min read

Antimicrobial resistance (AMR) today stands at the center of a slow-burning global emergency, one that scientists such as Dame Sally Davies have compared to a “silent pandemic” capable of reversing a century of medical progress. While policymakers frequently reduce AMR to a technical problem—one of microbes evolving faster than medicines—the deeper reality is far more complex, woven from patterns of human neglect, corporate incentives, agricultural economics, political apathy, weak global coordination, environmental deterioration, and a widening gap between countries that can afford modern infection control systems and those that cannot. The story of AMR is not simply about bacteria outsmarting drugs; it is a story of how human behavior, global trade, climate change, urbanization, pharmaceutical decline, and governance failures continuously create ecological opportunities for resistance to evolve, settle, and explode into superbugs that move rapidly across borders. Investigators who have followed AMR for decades—from Ramanan Laxminarayan’s global modeling work to Tim Walsh’s early detection of NDM-1—have repeatedly warned that resistance does not “emerge” in a vacuum; it is produced by policy and practice. It is produced by the way antibiotics are used, misused, overused, distributed, subsidized, and sometimes deliberately abused in both medicine and agriculture, and by the ecosystems that political systems allow to degrade until resistant organisms circulate freely through soil, air, rivers, livestock, and food chains.
The medical misuse of antibiotics remains the most visible driver, but the roots go deeper than overprescription. Across many countries, antibiotics are routinely used not as therapeutic agents but as psychosocial reassurance—patients expect them, doctors prescribe them under pressure, and pharmacists dispense them without oversight. Countless investigations by the World Health Organization (WHO), including those led by Hanan Balkhy, have documented clinics in South Asia, Africa, and Latin America where antibiotics are prescribed for viral infections simply because patients equate antibiotic use with “proper treatment.” In India, for instance, studies conducted by AIIMS Delhi and the Indian Council of Medical Research (ICMR) have found that up to 60% of outpatient antibiotic prescriptions are unnecessary, often for self-limiting viral fevers, common colds, and mild respiratory infections that require symptomatic management rather than broad-spectrum antimicrobials.^1 Hospitals add another structural problem: incomplete treatment courses, incorrect dosage, and weak stewardship. When a patient receives a sub-therapeutic course—or a drug inappropriate for the infecting organism—the infection is not fully eradicated, allowing resistant mutants to survive and replicate. Investigators at the Royal Free Hospital in London have long emphasized that incorrect empiric therapy in the first 48 hours dramatically increases the risk of selecting for resistant strains, especially in ICU settings.^2 Every dose of an antibiotic exerts evolutionary pressure on microbes, and when that pressure is misapplied—too short, too weak, or too broad—it becomes a near-perfect recipe for driving resistance.
Yet medicine is only half the equation. The agricultural sector uses more antibiotics globally than human healthcare does—nearly two-thirds, as repeatedly emphasized in UN FAO and WHO joint reports, and in the landmark 2019 UN Interagency Coordination Group (IACG) report.^3 Investigators in the European Medicines Agency (EMA) spent almost a decade showing how Europe’s ban on growth-promoting antibiotic use, combined with surveillance mechanisms like the European Surveillance of Veterinary Antimicrobial Consumption (ESVAC), dramatically reduced agricultural antibiotic use from 2011 onward. But in emerging economies such as India, China, Brazil, Vietnam, and parts of sub-Saharan Africa, antibiotics remain integral to livestock economics. Farmers use them not only to treat disease but to promote growth, accelerate weight gain, and compensate for poor hygiene conditions. When antimicrobials become cheaper than modernizing farm infrastructure—ventilation, waste management, water sanitation—economic incentives align with misuse, creating fertile ground for resistant organisms. Investigations in China’s Shandong and Guangdong provinces uncovered rampant use of colistin—a last-resort antibiotic—as a growth promoter in pigs and poultry until the discovery of the MCR-1 resistance gene in 2015 forced regulatory bans.^4 The MCR-1 gene, found by Chinese scientist Liu Jinxin and later analyzed by Timothy Walsh and colleagues, provided a chilling demonstration of agricultural misuse feeding global AMR: a single resistance gene originating in livestock spread within months to clinical isolates in more than 30 countries.
Environmental pathways represent an even more disturbing dimension of AMR, one that historian-investigators such as Jim O’Neill, head of the 2016 AMR Review, have argued remains persistently underestimated. The UN Environment Programme (UNEP) has repeatedly reported that rivers downstream of pharmaceutical manufacturing plants—particularly in India’s Hyderabad region, one of the world’s largest hubs for generic drug production—contain antibiotic concentrations comparable to therapeutic doses.^5 Investigations by Swedish researchers from Uppsala University, who sampled Patancheru wastewater, found ciprofloxacin concentrations up to 1000 times higher than levels known to select for resistance. These contaminated waters feed into irrigation systems, enter nearby villages, and mix with municipal runoff, creating an open-air laboratory for AMR evolution. Similarly, studies in Pakistan, Bangladesh, Kenya, and Argentina have found hospital wastewater to be a central node in the emergence and dissemination of resistant organisms, with pathogens like Klebsiella pneumoniae, Acinetobacter baumannii, and Pseudomonas aeruginosashowing increasingly multidrug-resistant (MDR) patterns.^6
Climate change further complicates the landscape. A pivotal 2022 study published in The Lancet Planetary Health by Xiao Wu and colleagues showed that countries with higher levels of PM2.5 air pollution also exhibited higher levels of antibiotic resistance across major bacterial pathogens, suggesting that airborne particulate matter acts as a vehicle for both resistant organisms and resistance genes.^7 Fine particulate pollution carries microbes, DNA fragments, and antibiotic residues, enabling long-distance transmission. As temperatures rise, bacterial replication accelerates, survival windows lengthen, and environmental niches expand. Floods, driven by climate extremes, distribute resistant organisms across wider areas; droughts concentrate contaminants in shrinking water bodies; and heatwaves amplify hospital infection loads. This multifactorial relationship means AMR is not merely a biomedical challenge but an environmental phenomenon shaped by atmospheric, hydrological, and ecological currents.
The link between poor sanitation and AMR is equally critical. WHO and UNICEF estimates show that 2.2 billion people still lack safely managed drinking water systems. In these contexts, water becomes the primary vector for resistant organisms, especially in overcrowded informal settlements where human waste, animal waste, and agricultural runoff converge. Investigations of South Asian river systems—particularly India’s Ganges basin—have repeatedly found high densities of extended-spectrum beta-lactamase (ESBL)-producing E. coli, NDM-1 positive bacteria, and carbapenem-resistant Klebsiella, especially near urban slums, hospitals, and religious bathing sites.^8 Field investigators from the Public Health Foundation of India (PHFI) documented how pilgrims who bathe in river waters during festivals acquire resistant gut flora that they later carry back to cities and villages, turning AMR into a form of microbial travel. Similar patterns appear in Africa’s Lake Victoria region, where local health workers report that fishermen exposed to contaminated waters exhibit higher rates of resistant infections unrelated to antibiotic use, demonstrating that environmental exposure alone can colonize human microbiota with resistance traits.^9
Superbugs—an informal term referring to organisms resistant to multiple antimicrobials—emerged as the most visible consequence of these overlapping pressures. The rise of NDM-1 (New Delhi Metallo-β-lactamase-1) in 2008–2010 remains one of the most dramatic illustrations of resistance evolution and global spread. Discovered by Walsh, Kumarasamy, and their collaborators, NDM-1 was first identified in a Swedish patient who had received medical treatment in New Delhi.^10 The gene, carried on mobile plasmids, rendered bacteria resistant to carbapenems—powerful antibiotics considered the last line of defense. Within a year, NDM-1 was detected in clinical samples in Pakistan, the United Kingdom, Canada, Australia, Kenya, and Japan. The rapid spread demonstrated how global travel, medical tourism, and gaps in sanitation infrastructures could accelerate AMR far beyond any single country’s borders. The outbreak also exposed tensions between nations: Indian officials pushed back against the naming of NDM-1, calling it “unfair,” while British, Pakistani, and American researchers insisted that political sensitivities could not override scientific transparency. The controversy itself revealed a governance gap—AMR does not respect borders, but the politics of naming, acknowledging, and managing outbreaks often does.
Other superbugs followed similar trajectories. Carbapenem-resistant Enterobacteriaceae (CRE), especially KPC-producing strains, spread rapidly across Italy, Israel, and the United States from the late 2000s onward, leading to hospital shutdowns, ICU outbreaks, and mortality rates exceeding 50% in some cases.^11 The United States Centers for Disease Control and Prevention (CDC) labeled CRE “one of the most urgent public health threats” due to its ease of transmission and limited treatment options. In Brazil and Colombia, OXA-48 producing strains caused widespread outbreaks in tertiary care hospitals, while in Southeast Asia, the combination of ESBL-producing strains and high environmental contamination led to a near-constant baseline of resistant infections.
The fungal superbug Candida auris, first identified in 2009 in Japan but later found to have emerged independently in India, South Africa, and Venezuela, added another layer of complexity. C. auris thrives in warm, humid environments and resists standard disinfectants. Investigations by the CDC and the UK’s Public Health England (now UKHSA) showed that C. auris could survive for weeks on hospital surfaces, colonizing equipment, walls, and bedding. The fungus’s simultaneous emergence on multiple continents led scientists such as Arturo Casadevall to hypothesize a climate-related mechanism: rising global temperatures may have selected for fungal strains capable of surviving at human body temperature.^12
Pharmaceutical dynamics represent a quieter yet equally critical part of the AMR story. The global antibiotic pipeline has been shrinking for decades due to limited commercial incentives. Antibiotics are curative, short-course therapies; unlike drugs for chronic illnesses, they generate little long-term profit. When a new antibiotic is developed, stewardship policies often restrict its use to prevent resistance, which paradoxically disincentivizes manufacturers. Major pharmaceutical companies such as Sanofi, Novartis, AstraZeneca, and Johnson & Johnson have significantly reduced their antibiotic R&D programs since the early 2000s, leaving small biotechnology companies to fill the gap. Some of these smaller companies, including Achaogen—developer of plazomicin, an antibiotic approved in 2018—went bankrupt shortly after launching their products, revealing the broken market structure for antibiotics.^13
Still, innovation continues in pockets, as seen in the announcement of GanLum, a new antimalarial developed jointly by Novartis and the Medicines for Malaria Venture (MMV). In clinical trials across 12 African countries, GanLum showed 97% effectiveness even in regions with established resistance to artemisinin-based therapies.^14 Scientists described the drug as “a fire extinguisher ready for the coming blaze,” underscoring the urgency of developing treatments before resistance outpaces them. But malaria resistance is only one thread; bacterial and fungal resistance remain chronically underfunded areas despite being responsible for far more global deaths annually.
Global governance efforts have attempted to respond to AMR, but progress remains fragmented. The World Economic Forum (WEF), during its 2025 Annual Meeting in Davos, facilitated the release of the Davos Compact on AMR through its Global Future Council on Tackling Antimicrobial Resistance. The compact outlined strategies for public–private collaboration, emphasizing innovation funding, sustainable food systems, and multi-sectoral engagement.^15 The Unified Coalition for the AMR Response (UCARE), launched simultaneously by the WEF’s Centre for Health and Healthcare, brought together governments, philanthropic entities, biotech companies, and global institutions in an effort to break existing silos in AMR governance. UCARE’s focus areas—including improving access to diagnostics and vaccines, supporting antimicrobial development, raising awareness, and promoting sustainable agriculture—reflect the One Health vision increasingly endorsed by WHO, FAO, OIE (now WOAH), and UNEP.^16
The One Health paradigm, which recognizes the interconnectedness of human health, animal health, plant health, and environmental systems, has become central to AMR policy. Investigators across multiple sectors highlight that resistant organisms move fluidly between humans, animals, soil, air, and water; therefore, interventions limited to hospitals or clinics will inevitably fail. For example, the discovery of the NDM-1 gene in drinking water and seepage samples from Delhi neighborhoods demonstrated that environmental contamination can maintain resistance regardless of hospital stewardship measures.^17 Similarly, Denmark’s experience with eliminating growth-promoting antibiotics in pigs showed that animal health can be maintained through improved hygiene, vaccination, and biosecurity, contradicting claims that agriculture requires routine antibiotic use for economic viability.^18
However, the risks associated with AMR extend beyond clinical settings and agriculture. Global food systems have increasingly become vectors for resistant organisms. Investigations by the European Food Safety Authority (EFSA) repeatedly found ESBL-producing E. coli in retail chicken meat, while US FDA surveillance detected rising rates of multidrug-resistant Salmonella and Campylobacter in supermarket poultry. International trade, especially in seafood, further complicates the picture; shrimp farms in Southeast Asia, which often use antibiotics in aquaculture, export products worldwide, creating transboundary pathways for resistance. When consumers handle contaminated raw meat, resistant organisms can colonize their gut without causing symptoms, silently spreading through populations until a clinical infection reveals the underlying resistance burden.
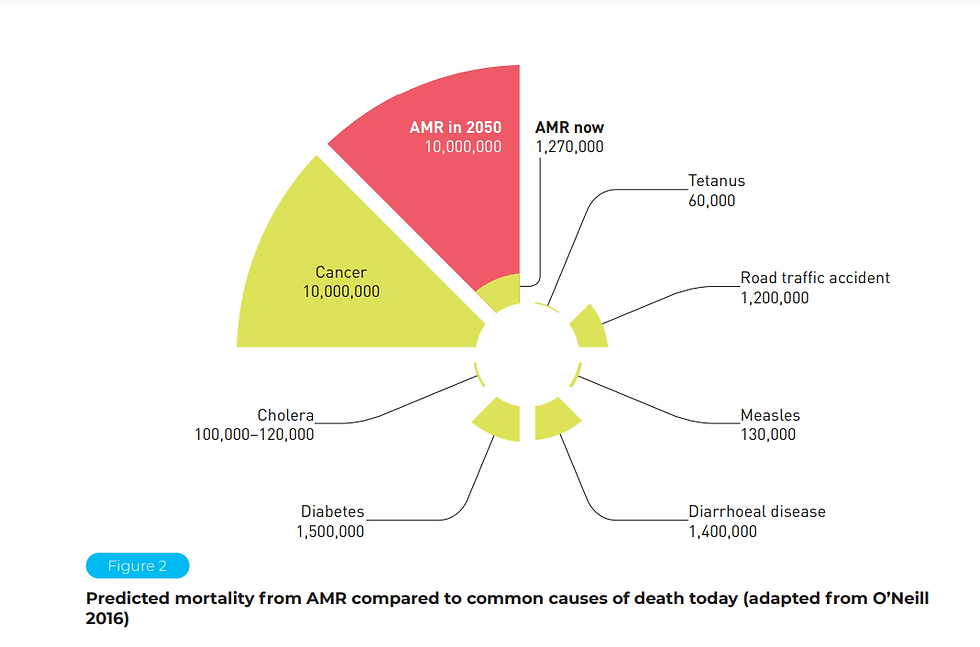
The global health implications of AMR are profound. A landmark 2022 analysis published in The Lancet estimated that AMR was directly responsible for 1.27 million deaths in 2019 and associated with nearly 5 million deaths—figures comparable to, or exceeding, the annual toll of HIV/AIDS and malaria combined.^19 These deaths disproportionately occur in low- and middle-income countries where laboratory capacity is limited, infection control resources are thin, and access to effective antibiotics is inconsistent. Investigators in Nigeria, Tanzania, Indonesia, and Nepal frequently report cases where clinicians must treat severe infections blind—without diagnostic support—resulting in broad-spectrum empirical therapy that fuels further resistance. In contrast, hospitals in the United States or Germany can perform rapid molecular diagnostics, identify resistance mechanisms, and implement targeted therapy. This inequality—between countries with advanced diagnostic ecosystems and those without—creates global pockets where resistance can emerge unchecked.
The economic consequences are equally devastating. The World Bank’s 2017 and 2022 AMR economic modeling studies warned that, without intervention, AMR could push up to 28 million people into extreme poverty by 2050 and reduce global GDP by 1% to 3.8%, depending on severity.^20 The agricultural sector would suffer disproportionately due to reduced productivity, livestock mortality, and loss of trade. Health systems would face soaring costs associated with prolonged hospital stays, expensive last-line drugs, and increasing ICU burdens. For example, treatment of carbapenem-resistant infections in US hospitals can cost more than $60,000 per patient, compared to $10,000 for susceptible infections.^21
Yet these statistics do not capture the lived reality of AMR: surgeries that become too dangerous to perform, cancer chemotherapy rendered ineffective due to infection risk, organ transplants postponed indefinitely, and neonates dying from infections once considered easily treatable. Investigators in Malawi’s Queen Elizabeth Central Hospital have documented neonates dying from sepsis caused by ESBL-producing organisms, while oncologists in the United Kingdom report cases where patients cannot receive chemotherapy because the risk of AMR infections outweighs the benefits of cancer treatment.^22 The ripple effects extend into every branch of modern medicine.
Improving water, sanitation, and hygiene (WASH) infrastructure remains one of the most powerful tools for mitigating AMR, yet political investment remains insufficient. WHO estimates that more than half of health facilities in sub-Saharan Africa lack basic handwashing stations at points of care. In these settings, resistant organisms spread easily between patients, staff, and surfaces. Hand hygiene, sterilization, and waste management—simple measures often taken for granted in wealthy countries—become life-or-death determinants. Investigative reports by Médecins Sans Frontières (MSF) found that war zones like Yemen and Syria exhibit extraordinarily high rates of AMR due to destroyed sanitation infrastructure, overcrowded hospitals, and repeated interruptions in antibiotic supply chains.^23
In recent years, researchers have highlighted the urgency of anticipatory governance—a proactive, forward-looking approach to AMR. Rather than reacting to crises, anticipatory governance requires building predictive models, identifying early warning signs, and coordinating global action to prevent outbreaks before they escalate. Scholars such as Steven Hoffman at York University argue that the world continues to “play catch-up” with superbugs because political systems respond only when resistance becomes an immediate clinical threat.^24 The slow-moving nature of AMR makes it easy for leaders to deprioritize investment, yet the long-term payoff of action is immense; as Sally Davies often states, every dollar spent on AMR prevention saves ten in future healthcare costs.^25
The solutions are well known but under-implemented: strengthening stewardship, regulating pharmaceutical waste, reducing agricultural misuse, increasing vaccine coverage, investing in diagnostics, improving sanitation, funding antibiotic innovation, and enhancing global surveillance. The challenge lies not in identifying interventions but in coordinating them across sectors, nations, and political interests. AMR demands a truly global response—one that fuses science, economics, politics, and environmental management under a unified strategy.
As the world continues to grapple with environmental degradation, expanding agriculture, pharmaceutical pollution, and warming climates, the conditions for AMR evolution intensify. The superbug explosion is not a distant future scenario—it is happening now, in hospital wards, riverbeds, poultry farms, and urban air. Unless coordinated global action accelerates dramatically, the 21st century may become the era in which humanity loses its antimicrobial shield. As investigators across the scientific and medical communities continue to warn, the cost of inaction will not be measured only in deaths but in the collapse of modern medical certainty itself.
References
Indian Council of Medical Research (ICMR), “Antibiotic Use and Stewardship in India,” 2021.
Royal Free Hospital Infection Control Committee, “Empiric Therapy and AMR Risk,” London, 2019.
UN Interagency Coordination Group on AMR (IACG), “No Time to Wait,” 2019.
Liu Jinxin et al., “Emergence of MCR-1,” The Lancet Infectious Diseases, 2016.
Swedish Uppsala University Environmental AMR Group, “Pharmaceutical Pollution in Patancheru,” 2018.
Public Health Foundation of India (PHFI), “Hospital Wastewater and AMR,” 2020.
Xiao Wu et al., “PM2.5 and Global AMR Correlation,” The Lancet Planetary Health, 2022.
PHFI River Surveillance Project, “AMR in the Ganges Basin,” 2019.
East African Health Observatory, “Lake Victoria AMR Exposure Study,” 2020.
Kumarasamy K. et al., “NDM-1 Carbapenemase,” The Lancet Infectious Diseases, 2010.
CDC, “CRE: Clinical Alert,” Atlanta, 2013.
Arturo Casadevall, “Climate Hypothesis for Candida auris,” mBio, 2020.
Achaogen Bankruptcy Filing, U.S. Federal Courts, 2019.
Novartis & Medicines for Malaria Venture, “GanLum Clinical Trial Report,” 2024.
World Economic Forum, “Davos Compact on AMR,” Davos, 2025.
Unified Coalition for AMR Response (UCARE), Policy Brief, 2025.
Walsh, T., “Environmental Presence of NDM-1,” Cardiff University Report, 2013.
Danish Ministry of Food, “Impact of AGP Ban,” Copenhagen, 2015.
Antimicrobial Resistance Collaborators, “Global Burden of AMR,” The Lancet, 2022.
World Bank, “Drug-Resistant Infections: Economic Threat,” 2022.
CDC Economic Burden Study, “Cost of Carbapenem Resistance,” 2021.
Malawi Neonatal Sepsis Study, Queen Elizabeth Central Hospital, 2020.
MSF Field Report, “AMR in Conflict Zones,” Yemen/Syria, 2022.
Hoffman, Steven, “Anticipatory Governance for AMR,” Global Strategy Lab, 2021.
Sally Davies, “AMR Funding Appeal,” UK Chief Medical Officer Lecture, 2018.




हिंदी अनुवाद
एंटीमाइक्रोबियल रेजिस्टेंस (AMR) आज एक धीमी गति से फैल रही वैश्विक इमरजेंसी के केंद्र में है, जिसकी तुलना डेम सैली डेविस जैसे वैज्ञानिकों ने एक “साइलेंट महामारी” से की है जो एक सदी की मेडिकल तरक्की को पलट सकती है। जबकि पॉलिसी मेकर्स अक्सर AMR को एक टेक्निकल प्रॉब्लम मान लेते हैं—एक तो यह कि माइक्रोब्स दवाओं से ज़्यादा तेज़ी से डेवलप हो रहे हैं—लेकिन गहरी सच्चाई कहीं ज़्यादा जटिल है, जो इंसानी लापरवाही, कॉर्पोरेट इंसेंटिव, एग्रीकल्चरल इकोनॉमिक्स, पॉलिटिकल उदासीनता, कमज़ोर ग्लोबल कोऑर्डिनेशन, एनवायरनमेंटल बिगड़ना, और उन देशों के बीच बढ़ते गैप से बुनी हुई है जो मॉडर्न इन्फेक्शन कंट्रोल सिस्टम वहन कर सकते हैं और जो नहीं कर सकते। AMR की कहानी सिर्फ़ बैक्टीरिया के दवाओं को मात देने के बारे में नहीं है; यह कहानी है कि कैसे इंसानी व्यवहार, ग्लोबल ट्रेड, क्लाइमेट चेंज, शहरीकरण, फार्मास्यूटिकल गिरावट, और गवर्नेंस की नाकामी लगातार रेजिस्टेंस के लिए इकोलॉजिकल मौके बनाती है ताकि वे डेवलप हों, बस जाएं, और सुपरबग्स में बदल जाएं जो तेज़ी से बॉर्डर पार करते हैं। जिन इन्वेस्टिगेटर्स ने दशकों से AMR को फॉलो किया है—रामनन लक्ष्मीनारायण के ग्लोबल मॉडलिंग वर्क से लेकर टिम वॉल्श के NDM-1 का जल्दी पता लगाने तक—उन्होंने बार-बार चेतावनी दी है कि रेजिस्टेंस वैक्यूम में “उभरता” नहीं है; यह नीति और व्यवहार से उत्पन्न होता है। यह एंटीबायोटिक दवाओं के उपयोग, दुरुपयोग, अति प्रयोग, वितरण, सब्सिडी और कभी-कभी दवा और कृषि दोनों में जानबूझकर दुरुपयोग के तरीके से उत्पन्न होता है, और उन पारिस्थितिकी तंत्रों द्वारा भी उत्पन्न होता है जिन्हें राजनीतिक व्यवस्थाएं तब तक खराब होने देती हैं जब तक कि प्रतिरोधी जीव मिट्टी, हवा, नदियों, पशुओं और खाद्य श्रृंखलाओं में स्वतंत्र रूप से प्रसारित नहीं हो जाते।
एंटीबायोटिक दवाओं का चिकित्सा दुरुपयोग सबसे अधिक दिखाई देने वाला कारण बना हुआ है, लेकिन इसकी जड़ें अत्यधिक नुस्खे से कहीं अधिक गहरी हैं। कई देशों में, एंटीबायोटिक दवाओं का नियमित रूप से चिकित्सीय एजेंट के रूप में नहीं बल्कि मानसिक आश्वासन के रूप में उपयोग किया जाता है - रोगी उनकी अपेक्षा करते हैं, डॉक्टर उन्हें दबाव में लिखते हैं, और फार्मासिस्ट उन्हें बिना निगरानी के देते हैं। विश्व स्वास्थ्य संगठन (डब्ल्यूएचओ) द्वारा अनगिनत जांचों, जिनमें हनान बाल्खी के नेतृत्व में की गई जांच भी शामिल है, ने दक्षिण एशिया, अफ्रीका और लैटिन अमेरिका के क्लीनिकों का दस्तावेजीकरण किया है जहां वायरल संक्रमण के लिए एंटीबायोटिक्स केवल इसलिए निर्धारित की जाती उदाहरण के लिए, भारत में AIIMS दिल्ली और इंडियन काउंसिल ऑफ़ मेडिकल रिसर्च (ICMR) की स्टडीज़ में पाया गया है कि 60% तक आउटपेशेंट एंटीबायोटिक प्रिस्क्रिप्शन गैर-ज़रूरी होते हैं, अक्सर खुद को कम करने वाले वायरल बुखार, आम सर्दी-ज़ुकाम और हल्के सांस के इन्फेक्शन के लिए, जिनके लिए ब्रॉड-स्पेक्ट्रम एंटीमाइक्रोबियल के बजाय लक्षणों वाले मैनेजमेंट की ज़रूरत होती है।^1 हॉस्पिटल एक और स्ट्रक्चरल समस्या जोड़ते हैं: अधूरे ट्रीटमेंट कोर्स, गलत डोज़ और कमज़ोर मैनेजमेंट। जब किसी मरीज़ को सब-थेराप्यूटिक कोर्स मिलता है—या ऐसी दवा जो इन्फेक्शन करने वाले जीव के लिए सही नहीं होती—तो इन्फेक्शन पूरी तरह से खत्म नहीं होता, जिससे रेसिस्टेंट म्यूटेंट ज़िंदा रहते हैं और अपनी संख्या बढ़ाते हैं। लंदन के रॉयल फ्री हॉस्पिटल के इन्वेस्टिगेटर्स ने लंबे समय से इस बात पर ज़ोर दिया है कि पहले 48 घंटों में गलत एम्पिरिक थेरेपी से रेसिस्टेंट स्ट्रेन चुनने का खतरा बहुत बढ़ जाता है, खासकर ICU सेटिंग्स में।^2 एंटीबायोटिक की हर डोज़ माइक्रोब्स पर इवोल्यूशनरी प्रेशर डालती है, और जब वह प्रेशर गलत तरीके से लगाया जाता है—बहुत कम, बहुत कमज़ोर, या बहुत ज़्यादा—तो यह रेसिस्टेंस बढ़ाने का लगभग परफेक्ट तरीका बन जाता है।
फिर भी दवा सिर्फ़ आधी इक्वेशन है। दुनिया भर में खेती-बाड़ी के सेक्टर में इंसानों की हेल्थकेयर से ज़्यादा एंटीबायोटिक्स का इस्तेमाल होता है—लगभग दो-तिहाई, जैसा कि UN FAO और WHO की जॉइंट रिपोर्ट और 2019 की मशहूर UN इंटरएजेंसी कोऑर्डिनेशन ग्रुप (IACG) रिपोर्ट में बार-बार ज़ोर दिया गया है।^3 यूरोपियन मेडिसिन एजेंसी (EMA) के इन्वेस्टिगेटर्स ने लगभग एक दशक तक यह दिखाया कि कैसे यूरोप में ग्रोथ बढ़ाने वाले एंटीबायोटिक के इस्तेमाल पर बैन, यूरोपियन सर्विलांस ऑफ़ वेटरनरी एंटीमाइक्रोबियल कंजम्पशन (ESVAC) जैसे सर्विलांस मैकेनिज्म के साथ मिलकर, 2011 के बाद से खेती-बाड़ी में एंटीबायोटिक के इस्तेमाल में काफ़ी कमी आई। लेकिन भारत, चीन, ब्राज़ील, वियतनाम और सब-सहारा अफ्रीका के कुछ हिस्सों जैसी उभरती अर्थव्यवस्थाओं में, एंटीबायोटिक्स जानवरों की इकोनॉमिक्स का ज़रूरी हिस्सा बने हुए हैं। किसान इनका इस्तेमाल न सिर्फ़ बीमारी का इलाज करने के लिए करते हैं, बल्कि ग्रोथ को बढ़ावा देने, वज़न बढ़ाने में तेज़ी लाने और खराब साफ़-सफ़ाई की स्थिति की भरपाई के लिए भी करते हैं। जब एंटीमाइक्रोबियल्स खेत के इंफ्रास्ट्रक्चर—वेंटिलेशन, वेस्ट मैनेजमेंट, पानी की सफ़ाई—को मॉडर्न बनाने से सस्ते हो जाते हैं, तो आर्थिक फ़ायदे गलत इस्तेमाल के साथ जुड़ जाते हैं, जिससे प्रतिरोधी जीवों के लिए उपजाऊ ज़मीन तैयार होती है। चीन के शैनडोंग और ग्वांगडोंग प्रांतों में हुई जांच में पता चला कि सूअरों और पोल्ट्री में ग्रोथ प्रमोटर के तौर पर कोलिस्टिन का बहुत ज़्यादा इस्तेमाल हो रहा था – यह एक आखिरी एंटीबायोटिक है। 2015 में MCR-1 रेजिस्टेंस जीन की खोज के बाद रेगुलेटरी बैन लगाने पड़े।^4 MCR-1 जीन, जिसे चीनी साइंटिस्ट लियू जिनक्सिन ने खोजा था और बाद में टिमोथी वॉल्श और उनके साथियों ने इसका एनालिसिस किया, ने खेती-बाड़ी के गलत इस्तेमाल का एक डरावना सबूत दिया, जिससे दुनिया भर में AMR फैल रहा है: जानवरों से निकला एक रेजिस्टेंस जीन कुछ ही महीनों में 30 से ज़्यादा देशों में क्लिनिकल आइसोलेट्स में फैल गया।
एनवायरनमेंटल रास्ते AMR का एक और भी परेशान करने वाला पहलू दिखाते हैं, जिसके बारे में 2016 AMR रिव्यू के हेड जिम ओ'नील जैसे इतिहासकार-जांच करने वालों का कहना है कि इसे लगातार कम करके आंका जाता है। UN एनवायरनमेंट प्रोग्राम (UNEP) ने बार-बार बताया है कि दवा बनाने वाले प्लांट के नीचे की नदियों में – खासकर भारत के हैदराबाद इलाके में, जो जेनेरिक दवा बनाने के लिए दुनिया के सबसे बड़े हब में से एक है – एंटीबायोटिक का कंसंट्रेशन थेराप्यूटिक डोज़ के बराबर होता है।^5 उप्साला यूनिवर्सिटी के स्वीडिश रिसर्चर्स ने, जिन्होंने पटनचेरू के गंदे पानी का सैंपल लिया था, जांच में पाया कि सिप्रोफ्लोक्सासिन का कंसंट्रेशन रेजिस्टेंस के लिए जाने जाने वाले लेवल से 1000 गुना ज़्यादा था। यह गंदा पानी सिंचाई सिस्टम में जाता है, आस-पास के गांवों में जाता है, और म्युनिसिपल रनऑफ के साथ मिलकर AMR के बढ़ने के लिए एक खुली लैब बनाता है। इसी तरह, पाकिस्तान, बांग्लादेश, केन्या और अर्जेंटीना में हुई स्टडीज़ में पाया गया है कि हॉस्पिटल का गंदा पानी, रेसिस्टेंट जीवों के बनने और फैलने में एक सेंट्रल नोड है, जिसमें क्लेबसिएला न्यूमोनिया, एसिनेटोबैक्टर बाउमानी और स्यूडोमोनास एरुगिनोसा जैसे पैथोजन्स तेज़ी से मल्टीड्रग-रेसिस्टेंट (MDR) पैटर्न दिखा रहे हैं।^6
क्लाइमेट चेंज ने हालात को और मुश्किल बना दिया है। द लैंसेट प्लैनेटरी हेल्थ में ज़ियाओ वू और उनके साथियों की 2022 की एक ज़रूरी स्टडी से पता चला है कि जिन देशों में PM2.5 एयर पॉल्यूशन का लेवल ज़्यादा था, उनमें मुख्य बैक्टीरियल पैथोजन्स में एंटीबायोटिक रेसिस्टेंस का लेवल भी ज़्यादा था, जिससे पता चलता है कि हवा में मौजूद पार्टिकुलेट मैटर रेसिस्टेंट जीवों और रेसिस्टेंट जीन दोनों के लिए एक व्हीकल का काम करते हैं।^7 फाइन पार्टिकुलेट पॉल्यूशन में माइक्रोब्स, DNA के टुकड़े और एंटीबायोटिक के बचे हुए हिस्से होते हैं, जिससे वे लंबी दूरी तक फैल सकते हैं। जैसे-जैसे तापमान बढ़ता है, बैक्टीरियल रेप्लीकेशन तेज़ होता है, सर्वाइवल विंडो लंबी होती जाती हैं, और एनवायरनमेंटल जगहें फैलती हैं। क्लाइमेट एक्सट्रीम की वजह से बाढ़, रेसिस्टेंट जीवों को बड़े एरिया में फैला देती है; सूखे की वजह से पानी की सिकुड़ती जगहों में गंदगी जमा हो जाती है; और गर्मी की लहरों से अस्पतालों में इंफेक्शन का खतरा बढ़ जाता है। इस कई वजहों से जुड़े रिश्ते का मतलब है कि AMR सिर्फ़ एक बायोमेडिकल चुनौती नहीं है, बल्कि यह एक एनवायर्नमेंटल घटना है जो एटमोस्फेरिक, हाइड्रोलॉजिकल और इकोलॉजिकल धाराओं से बनती है।
खराब सफ़ाई और AMR के बीच का लिंक भी उतना ही ज़रूरी है। WHO और UNICEF के अनुमान बताते हैं कि 2.2 बिलियन लोगों के पास अभी भी सुरक्षित रूप से मैनेज किए गए पीने के पानी के सिस्टम नहीं हैं। इन हालात में, पानी प्रतिरोधी जीवों के लिए मुख्य वेक्टर बन जाता है, खासकर भीड़भाड़ वाली अनौपचारिक बस्तियों में जहाँ इंसानी मल, जानवरों का मल और खेती का पानी एक साथ मिलता है। साउथ एशियन नदी सिस्टम की जांच में—खासकर इंडिया के गंगा बेसिन में—बार-बार एक्सटेंडेड-स्पेक्ट्रम बीटा-लैक्टामेज (ESBL) बनाने वाले E. कोलाई, NDM-1 पॉजिटिव बैक्टीरिया, और कार्बापेनम-रेसिस्टेंट क्लेबसिएला की हाई डेंसिटी पाई गई है, खासकर शहरी झुग्गी-झोपड़ियों, अस्पतालों और धार्मिक नहाने की जगहों के पास।^8 पब्लिक हेल्थ फाउंडेशन ऑफ इंडिया (PHFI) के फील्ड इन्वेस्टिगेटर्स ने डॉक्यूमेंट किया कि कैसे त्योहारों के दौरान नदी के पानी में नहाने वाले तीर्थयात्रियों के गट फ्लोरा में रेसिस्टेंट बैक्टीरिया आ जाते हैं, जिन्हें वे बाद में शहरों और गांवों में वापस ले जाते हैं, जिससे AMR एक तरह का माइक्रोबियल ट्रैवल बन जाता है। अफ्रीका के लेक विक्टोरिया इलाके में भी ऐसे ही पैटर्न दिखते हैं, जहां लोकल हेल्थ वर्कर्स बताते हैं कि खराब पानी के संपर्क में आने वाले मछुआरों में एंटीबायोटिक इस्तेमाल से अलग रेसिस्टेंट इन्फेक्शन के मामले ज़्यादा होते हैं, जिससे पता चलता है कि सिर्फ एनवायरनमेंटल एक्सपोजर ही रेसिस्टेंट गुणों वाले ह्यूमन माइक्रोबायोटा को कॉलोनी बना सकता है।^9
सुपरबग्स—एक इनफॉर्मल शब्द जो कई एंटीमाइक्रोबियल्स के लिए रेसिस्टेंट ऑर्गेनिज्म को बताता है—इन ओवरलैपिंग प्रेशर का सबसे साफ नतीजा बनकर सामने आया। 2008-2010 में NDM-1 (न्यू डेल्ही मेटालो-β-लैक्टामेस-1) का बढ़ना, रेजिस्टेंस के विकास और दुनिया भर में इसके फैलने के सबसे बड़े उदाहरणों में से एक है। वॉल्श, कुमारसामी और उनके साथियों द्वारा खोजे गए NDM-1 की पहचान सबसे पहले एक स्वीडिश मरीज़ में हुई थी, जिसका नई दिल्ली में मेडिकल इलाज हुआ था।^10 मोबाइल प्लास्मिड पर मौजूद इस जीन ने बैक्टीरिया को कार्बापेनेम्स के प्रति रेजिस्टेंट बना दिया – ये ताकतवर एंटीबायोटिक्स हैं जिन्हें बचाव की आखिरी लाइन माना जाता है। एक साल के अंदर, पाकिस्तान, यूनाइटेड किंगडम, कनाडा, ऑस्ट्रेलिया, केन्या और जापान में क्लिनिकल सैंपल में NDM-1 का पता चला। इसके तेज़ी से फैलने से पता चला कि कैसे दुनिया भर में ट्रैवल, मेडिकल टूरिज्म और सैनिटेशन इंफ्रास्ट्रक्चर में कमी AMR को किसी एक देश की सीमाओं से कहीं आगे तक बढ़ा सकती है। इस बीमारी ने देशों के बीच तनाव को भी उजागर किया: भारतीय अधिकारियों ने NDM-1 के नामकरण का विरोध किया, इसे "गलत" कहा, जबकि ब्रिटिश, पाकिस्तानी और अमेरिकी रिसर्चर्स ने ज़ोर देकर कहा कि राजनीतिक संवेदनशीलता साइंटिफिक ट्रांसपेरेंसी को ओवरराइड नहीं कर सकती। इस विवाद ने खुद ही गवर्नेंस की कमी को उजागर कर दिया - एएमआर सीमाओं का सम्मान नहीं करता है, लेकिन प्रकोपों का नामकरण, मान्यता और प्रबंधन करने की राजनीति अक्सर ऐसा करती है।
दूसरे सुपरबग्स ने भी ऐसा ही किया। कार्बापेनम-रेसिस्टेंट एंटरोबैक्टीरियासी (CRE), खासकर KPC बनाने वाले स्ट्रेन, 2000 के दशक के आखिर से इटली, इज़राइल और यूनाइटेड स्टेट्स में तेज़ी से फैले, जिससे हॉस्पिटल बंद हो गए, ICU में बीमारी फैल गई और कुछ मामलों में मौत की दर 50% से ज़्यादा हो गई।^11 यूनाइटेड स्टेट्स सेंटर्स फॉर डिज़ीज़ कंट्रोल एंड प्रिवेंशन (CDC) ने CRE को इसके आसानी से फैलने और इलाज के कम ऑप्शन की वजह से "सबसे ज़रूरी पब्लिक हेल्थ खतरों में से एक" बताया। ब्राज़ील और कोलंबिया में, OXA-48 बनाने वाले स्ट्रेन की वजह से टर्शियरी केयर हॉस्पिटल में बड़े पैमाने पर बीमारी फैली, जबकि साउथ-ईस्ट एशिया में, ESBL बनाने वाले स्ट्रेन और ज़्यादा एनवायरनमेंटल कंटैमिनेशन के कॉम्बिनेशन की वजह से रेसिस्टेंट इन्फेक्शन का बेसलाइन लगभग लगातार बना रहा।
फंगल सुपरबग कैंडिडा ऑरिस, जिसकी पहचान सबसे पहले 2009 में जापान में हुई थी, लेकिन बाद में पता चला कि यह इंडिया, साउथ अफ्रीका और वेनेजुएला में अलग-अलग पाया गया, ने मुश्किल की एक और परत जोड़ दी। सी. ऑरिस गर्म, नमी वाली जगहों पर पनपता है और आम डिसइंफेक्टेंट को झेल नहीं पाता। CDC और UK के पब्लिक हेल्थ इंग्लैंड (अब UKHSA) की जांच से पता चला कि सी. ऑरिस हॉस्पिटल की सतहों पर हफ्तों तक ज़िंदा रह सकता है, और इक्विपमेंट, दीवारों और बिस्तरों पर कब्ज़ा कर सकता है। कई कॉन्टिनेंट्स पर एक साथ फंगस के फैलने से आर्टुरो कैसाडेवाल जैसे साइंटिस्ट्स ने क्लाइमेट से जुड़े एक मैकेनिज्म का अंदाज़ा लगाया: दुनिया के बढ़ते टेम्परेचर ने शायद ऐसे फंगल स्ट्रेन्स को चुना होगा जो इंसानी शरीर के टेम्परेचर पर ज़िंदा रह सकते हैं।^12
फार्मास्यूटिकल डायनामिक्स AMR कहानी का एक शांत लेकिन उतना ही ज़रूरी हिस्सा है। कम कमर्शियल इंसेंटिव की वजह से दुनिया भर में एंटीबायोटिक पाइपलाइन दशकों से सिकुड़ रही है। एंटीबायोटिक्स इलाज करने वाली, कम समय की थेरेपी हैं; पुरानी बीमारियों की दवाओं के उलट, इनसे लंबे समय में बहुत कम प्रॉफिट होता है। जब कोई नया एंटीबायोटिक बनता है, तो मैनेजमेंट पॉलिसी अक्सर रेजिस्टेंस को रोकने के लिए उसके इस्तेमाल पर रोक लगा देती हैं, जिससे अजीब बात यह है कि मैन्युफैक्चरर्स का हौसला टूट जाता है। सनोफी, नोवार्टिस, एस्ट्राजेनेका और जॉनसन एंड जॉनसन जैसी बड़ी फार्मा कंपनियों ने 2000 के दशक की शुरुआत से अपने एंटीबायोटिक R&D प्रोग्राम काफी कम कर दिए हैं, जिससे छोटी बायोटेक्नोलॉजी कंपनियों को यह कमी पूरी करनी पड़ रही है। इनमें से कुछ छोटी कंपनियां, जिनमें अचोजेन भी शामिल है—प्लाज़ोमाइसिन की डेवलपर, जो 2018 में मंज़ूर एक एंटीबायोटिक है—अपने प्रोडक्ट लॉन्च करने के कुछ ही समय बाद दिवालिया हो गईं, जिससे एंटीबायोटिक्स के लिए टूटे हुए मार्केट स्ट्रक्चर का पता चलता है।^13
फिर भी, कुछ जगहों पर इनोवेशन जारी है, जैसा कि नोवार्टिस और मेडिसिन्स फॉर मलेरिया वेंचर (MMV) द्वारा मिलकर डेवलप की गई एक नई एंटीमलेरियल दवा गैनलम की घोषणा में देखा जा सकता है। 12 अफ्रीकी देशों में क्लिनिकल ट्रायल में, गैनलम ने उन इलाकों में भी 97% असर दिखाया जहां आर्टेमिसिनिन-बेस्ड थेरेपी के लिए रेजिस्टेंस पहले से मौजूद था।^14 साइंटिस्ट्स ने इस दवा को “आने वाली आग के लिए तैयार आग बुझाने वाला यंत्र” बताया, जिससे रेजिस्टेंस के उनसे आगे निकलने से पहले इलाज डेवलप करने की ज़रूरत पर ज़ोर दिया गया। लेकिन मलेरिया रेजिस्टेंस तो बस एक धागा है; बैक्टीरियल और फंगल रेजिस्टेंस ऐसे एरिया हैं जिन्हें हमेशा कम फंड मिलता है, जबकि हर साल दुनिया भर में इनकी वजह से बहुत ज़्यादा मौतें होती हैं।
ग्लोबल गवर्नेंस की कोशिशों ने AMR से निपटने की कोशिश की है, लेकिन प्रोग्रेस अभी भी बिखरी हुई है। वर्ल्ड इकोनॉमिक फोरम (WEF) ने दावोस में अपनी 2025 की सालाना मीटिंग के दौरान, एंटीमाइक्रोबियल रेजिस्टेंस से निपटने के लिए अपनी ग्लोबल फ्यूचर काउंसिल के ज़रिए AMR पर दावोस कॉम्पैक्ट को रिलीज़ करने में मदद की। इस कॉम्पैक्ट में पब्लिक-प्राइवेट सहयोग के लिए स्ट्रेटेजी बताई गईं, जिसमें इनोवेशन फंडिंग, सस्टेनेबल फूड सिस्टम और मल्टी-सेक्टरल एंगेजमेंट पर ज़ोर दिया गया।^15 WEF के सेंटर फॉर हेल्थ एंड हेल्थकेयर द्वारा एक साथ लॉन्च किया गया यूनिफाइड कोएलिशन फॉर द AMR रिस्पॉन्स (UCARE) ने AMR गवर्नेंस में मौजूदा रुकावटों को खत्म करने की कोशिश में सरकारों, समाजसेवी संस्थाओं, बायोटेक कंपनियों और ग्लोबल इंस्टीट्यूशन को एक साथ लाया। UCARE के फोकस एरिया—जिसमें डायग्नोस्टिक्स और वैक्सीन तक पहुंच को बेहतर बनाना, एंटीमाइक्रोबियल डेवलपमेंट को सपोर्ट करना, जागरूकता बढ़ाना और सस्टेनेबल खेती को बढ़ावा देना शामिल है—वन हेल्थ विज़न को दिखाते हैं, जिसे WHO, FAO, OIE (अब WOAH), और UNEP तेज़ी से सपोर्ट कर रहे हैं।^16
वन हेल्थ पैराडाइम, जो इंसानी सेहत, जानवरों की सेहत, पौधों की सेहत और एनवायरनमेंटल सिस्टम के आपसी जुड़ाव को पहचानता है, AMR पॉलिसी का सेंटर बन गया है। कई सेक्टर के इन्वेस्टिगेटर्स इस बात पर ज़ोर देते हैं कि रेजिस्टेंट ऑर्गेनिज़्म इंसानों, जानवरों, मिट्टी, हवा और पानी के बीच आसानी से घूमते हैं; इसलिए, सिर्फ़ हॉस्पिटल या क्लिनिक तक सीमित इंटरवेंशन ज़रूर फेल हो जाएंगे। उदाहरण के लिए, दिल्ली के आस-पास के इलाकों से पीने के पानी और सीपेज सैंपल में NDM-1 जीन की खोज ने दिखाया कि एनवायरनमेंटल कंटैमिनेशन हॉस्पिटल के मैनेजमेंट के उपायों के बावजूद रेजिस्टेंस बनाए रख सकता है।^17 इसी तरह, सूअरों में ग्रोथ-प्रमोटिंग एंटीबायोटिक्स को खत्म करने के डेनमार्क के अनुभव ने दिखाया कि बेहतर हाइजीन, वैक्सीनेशन और बायोसिक्योरिटी के ज़रिए जानवरों की सेहत को बनाए रखा जा सकता है, जो इस दावे को गलत साबित करता है कि खेती में आर्थिक रूप से फायदेमंद होने के लिए रेगुलर एंटीबायोटिक इस्तेमाल की ज़रूरत होती है।^18
लेकिन, AMR से जुड़े रिस्क क्लिनिकल सेटिंग्स और खेती से कहीं ज़्यादा हैं। ग्लोबल फ़ूड सिस्टम तेज़ी से रेजिस्टेंट जीवों के वेक्टर बन गए हैं। यूरोपियन फ़ूड सेफ़्टी अथॉरिटी (EFSA) की जांच में बार-बार रिटेल चिकन मीट में ESBL बनाने वाला E. कोलाई पाया गया, जबकि US FDA सर्विलांस में सुपरमार्केट पोल्ट्री में मल्टीड्रग-रेसिस्टेंट साल्मोनेला और कैम्पिलोबैक्टर की बढ़ती दर का पता चला। इंटरनेशनल ट्रेड, खासकर सीफ़ूड में, तस्वीर को और मुश्किल बनाता है; साउथ-ईस्ट एशिया में झींगा फ़ार्म, जो अक्सर एक्वाकल्चर में एंटीबायोटिक्स का इस्तेमाल करते हैं, दुनिया भर में प्रोडक्ट एक्सपोर्ट करते हैं, जिससे रेजिस्टेंस के लिए ट्रांसबाउंड्री रास्ते बनते हैं। जब कंज्यूमर खराब कच्चा मीट संभालते हैं, तो रेजिस्टेंट जीव बिना कोई लक्षण दिखाए उनके पेट में बस सकते हैं, और चुपचाप आबादी में तब तक फैलते रहते हैं जब तक कि कोई क्लिनिकल इंफेक्शन अंदरूनी रेजिस्टेंस का बोझ न दिखा दे।
AMR के ग्लोबल हेल्थ पर असर बहुत गहरे हैं। द लैंसेट में छपे एक अहम 2022 एनालिसिस में अनुमान लगाया गया कि AMR 2019 में 1.27 मिलियन मौतों के लिए सीधे तौर पर ज़िम्मेदार था और लगभग 5 मिलियन मौतों से जुड़ा था—ये आंकड़े HIV/AIDS और मलेरिया के सालाना कुल नुकसान के बराबर या उससे भी ज़्यादा हैं।^19 ये मौतें ज़्यादातर कम और मध्यम आय वाले देशों में होती हैं जहाँ लैब की क्षमता सीमित है, इन्फेक्शन कंट्रोल के साधन कम हैं, और असरदार एंटीबायोटिक्स तक पहुँच में कोई तालमेल नहीं है। नाइजीरिया, तंजानिया, इंडोनेशिया और नेपाल में इन्वेस्टिगेटर अक्सर ऐसे मामले रिपोर्ट करते हैं जहाँ डॉक्टरों को गंभीर इन्फेक्शन का इलाज बिना डायग्नोस्टिक मदद के करना पड़ता है—जिसके नतीजे में ब्रॉड-स्पेक्ट्रम एंपिरिकल थेरेपी होती है जो और ज़्यादा रेजिस्टेंस को बढ़ावा देती है। इसके उलट, अमेरिका या जर्मनी के अस्पताल तेज़ी से मॉलिक्यूलर डायग्नोस्टिक्स कर सकते हैं, रेजिस्टेंस के तरीकों की पहचान कर सकते हैं, और टारगेटेड थेरेपी लागू कर सकते हैं। यह असमानता—एडवांस्ड डायग्नोस्टिक इकोसिस्टम वाले देशों और जिनके पास नहीं है—के बीच दुनिया भर में ऐसे इलाके बनाती है जहाँ रेजिस्टेंस बिना रोक-टोक के उभर सकता है।
इसके आर्थिक नतीजे भी उतने ही खतरनाक हैं। वर्ल्ड बैंक की 2017 और 2022 की AMR इकोनॉमिक मॉडलिंग स्टडीज़ ने चेतावनी दी थी कि, बिना दखल के, AMR 2050 तक 28 मिलियन लोगों को बहुत ज़्यादा गरीबी में धकेल सकता है और गंभीरता के आधार पर ग्लोबल GDP को 1% से 3.8% तक कम कर सकता है।^20 कम प्रोडक्टिविटी, जानवरों की मौत और व्यापार में नुकसान के कारण एग्रीकल्चर सेक्टर को बहुत ज़्यादा नुकसान होगा। हेल्थ सिस्टम को लंबे समय तक हॉस्पिटल में रहने, महंगी लास्ट-लाइन दवाओं और बढ़ते ICU बोझ से जुड़े बढ़ते खर्चों का सामना करना पड़ेगा। उदाहरण के लिए, US हॉस्पिटल में कार्बापेनम-रेसिस्टेंट इन्फेक्शन के इलाज में हर मरीज़ पर $60,000 से ज़्यादा खर्च आ सकता है, जबकि ससेप्टिबल इन्फेक्शन के लिए $10,000 खर्च होते हैं।^21
फिर भी ये आंकड़े AMR की असलियत को नहीं दिखाते: सर्जरी जो करना बहुत खतरनाक हो जाता है, इन्फेक्शन के खतरे के कारण कैंसर कीमोथेरेपी का बेअसर हो जाना, ऑर्गन ट्रांसप्लांट को अनिश्चित काल के लिए टाल दिया जाना, और नवजात बच्चों का ऐसे इन्फेक्शन से मरना जिन्हें कभी आसानी से इलाज लायक माना जाता था। मलावी के क्वीन एलिज़ाबेथ सेंट्रल हॉस्पिटल में इन्वेस्टिगेटर्स ने देखा है कि नवजात बच्चे ESBL बनाने वाले ऑर्गेनिज़्म की वजह से होने वाले सेप्सिस से मर रहे हैं, जबकि यूनाइटेड किंगडम में ऑन्कोलॉजिस्ट ऐसे मामलों की रिपोर्ट करते हैं जहाँ मरीज़ों को कीमोथेरेपी नहीं मिल पाती क्योंकि AMR इन्फेक्शन का रिस्क कैंसर ट्रीटमेंट के फ़ायदों से ज़्यादा होता है।^22 इसका असर मॉडर्न मेडिसिन की हर ब्रांच तक फैला हुआ है।
पानी, सफ़ाई और हाइजीन (WASH) इंफ्रास्ट्रक्चर में सुधार AMR को कम करने के सबसे असरदार तरीकों में से एक है, फिर भी पॉलिटिकल इन्वेस्टमेंट काफ़ी नहीं है। WHO का अनुमान है कि सब-सहारा अफ्रीका में आधे से ज़्यादा हेल्थ सेंटर्स में केयर पॉइंट्स पर बेसिक हैंडवॉशिंग स्टेशन नहीं हैं। इन जगहों पर, रेजिस्टेंट ऑर्गेनिज़्म मरीज़ों, स्टाफ़ और सतहों के बीच आसानी से फैल जाते हैं। हाथ की सफ़ाई, स्टेरिलाइज़ेशन और वेस्ट मैनेजमेंट—अमीर देशों में अक्सर हल्के में लिए जाने वाले आसान उपाय—ज़िंदगी-या-मौत तय करने वाले बन जाते हैं। मेडिसिन्स सैन्स फ्रंटियर्स (MSF) की इन्वेस्टिगेटिव रिपोर्ट में पाया गया कि यमन और सीरिया जैसे वॉर ज़ोन में AMR की दर बहुत ज़्यादा है, क्योंकि सफ़ाई का इंफ़्रास्ट्रक्चर खराब हो गया है, हॉस्पिटल में बहुत ज़्यादा भीड़ है, और एंटीबायोटिक सप्लाई चेन में बार-बार रुकावट आती है।^23
हाल के सालों में, रिसर्चर्स ने एंटीसिपेटरी गवर्नेंस की ज़रूरत पर ज़ोर दिया है—AMR के लिए एक प्रोएक्टिव, आगे की सोचने वाला तरीका। संकटों पर रिएक्ट करने के बजाय, एंटीसिपेटरी गवर्नेंस के लिए प्रेडिक्टिव मॉडल बनाने, शुरुआती चेतावनी के संकेतों को पहचानने, और बीमारी के बढ़ने से पहले उसे रोकने के लिए ग्लोबल एक्शन को कोऑर्डिनेट करने की ज़रूरत होती है। यॉर्क यूनिवर्सिटी के स्टीवन हॉफ़मैन जैसे स्कॉलर का तर्क है कि दुनिया सुपरबग्स के साथ “कैच-अप” करती रहती है क्योंकि पॉलिटिकल सिस्टम तभी रिस्पॉन्ड करते हैं जब विरोध तुरंत क्लिनिकल खतरा बन जाता है।^24
AMR की धीमी गति की वजह से लीडर्स के लिए इन्वेस्टमेंट को प्राथमिकता न देना आसान हो जाता है, फिर भी लंबे समय में इसके फ़ायदे बहुत ज़्यादा होते हैं; जैसा कि सैली डेविस अक्सर कहती हैं, AMR की रोकथाम पर खर्च किया गया हर डॉलर भविष्य में हेल्थकेयर के खर्च में दस डॉलर बचाता है।^25
इसके समाधान तो पता हैं लेकिन उन्हें ठीक से लागू नहीं किया गया है: मैनेजमेंट को मज़बूत करना, दवा के कचरे को रेगुलेट करना, खेती का गलत इस्तेमाल कम करना, वैक्सीन कवरेज बढ़ाना, डायग्नोस्टिक्स में इन्वेस्ट करना, सफ़ाई में सुधार करना, एंटीबायोटिक इनोवेशन के लिए फ़ंडिंग करना और ग्लोबल निगरानी बढ़ाना। चुनौती दखल देने के तरीकों की पहचान करने में नहीं, बल्कि उन्हें अलग-अलग सेक्टर, देशों और राजनीतिक हितों के बीच कोऑर्डिनेट करने में है। AMR के लिए सच में ग्लोबल जवाब की ज़रूरत है—ऐसा जवाब जो साइंस, इकोनॉमिक्स, पॉलिटिक्स और एनवायरनमेंटल मैनेजमेंट को एक ही स्ट्रैटेजी के तहत मिलाए।
जैसे-जैसे दुनिया एनवायरनमेंटल गिरावट, खेती के बढ़ने, दवा के प्रदूषण और गर्म होते मौसम से जूझ रही है, AMR के बढ़ने के हालात और तेज़ होते जा रहे हैं। सुपरबग का फैलना कोई दूर की बात नहीं है—यह अभी हो रहा है, हॉस्पिटल के वार्ड, नदी के किनारे, पोल्ट्री फार्म और शहरी हवा में। अगर दुनिया भर में मिलकर काम करने में तेज़ी नहीं आई, तो 21वीं सदी वह दौर बन सकती है जिसमें इंसान अपनी एंटीमाइक्रोबियल शील्ड खो देगा। जैसा कि साइंटिफिक और मेडिकल कम्युनिटी के इन्वेस्टिगेटर लगातार चेतावनी दे रहे हैं, कुछ न करने की कीमत सिर्फ़ मौतों से नहीं, बल्कि मॉडर्न मेडिकल भरोसे के खत्म होने से भी चुकानी पड़ेगी।




Comments